вариант 3, страница 18, часть 1 - гдз по химии 8 класс тетрадь для практических работ Борушко

Авторы: Борушко И. И.
Тип: Тетрадь для практических работ
Издательство: Сэр-Вит
Год издания: 2022 - 2026
Часть: 1
Цвет обложки: розовый с пробирками
ISBN: 978-985-597-607-4
Рекомендовано Научно-методическим учреждением «Национальный институт образования» Министерства образования Республики Беларусь
Популярные ГДЗ в 8 классе
Часть 1. Практические работы. Практическая работа 4 - страница 18.
вариант 3 (с. 18)
Условие. вариант 3 (с. 18)
скриншот условия














1. Приготовление раствора с заданной массовой долей вещества
Задание 1
Приготовьте раствор, масса которого и массовая доля вещества в нем соответственно равны:
2. Растворение навески
Перенесите навеску соли в мерную колбу, используя воронку.
Навеска соли
кристаллы
соли
массой _____
растворена в _____
Добавьте небольшое количество воды (через воронку) и растворите кристаллы, покачивая колбу.
3. Доведение объема раствора до заданного
Долейте воду в раствор почти до кольцеобразной метки.
Уберите воронку.
С помощью пипетки добавьте воду так, чтобы нижний уровень мениска совпадал с меткой.
4. Подготовка раствора к хранению и последующему использованию:
перелейте приготовленный раствор в склянку для хранения (через воронку по стеклянной палочке);
приготовьте и наклейте этикетку.
На этикетке укажите:
химическую формулу вещества;
название вещества;
молярную концентрацию вещества в растворе.
Сдайте приготовленный раствор учителю (лаборанту).
Вывод: для приготовления раствора объемом _____ см$^{3}$, молярная концентрация _____ в котором равна _____, мне необходимо взвесить
Вывод:
Задание 3
Рассчитайте молярную концентрацию вещества в растворе, если для приготовления раствора объемом 500 см$^{3}$ использовали порцию:
в) соляной кислоты, масса вещества в котором 3,65 г;
Дано:
Решение
б) 120 г; 5% KCl;
I. Расчет необходимой массы вещества и объема воды
Дано:
$m(\text{р-ра}) = \text{.... г}$
$w(\text{...}) = \text{....}$
$m(\text{...}) = \text{?}$
$V(\text{...}) = \text{?}$
Решение
$w(\text{в-ва}) = \frac{m(\text{в-ва})}{m(\text{р-ра})}$, откуда
$m(\text{в-ва}) = m(\text{р-ра}) \cdot w(\text{в-ва})$
$m(\text{H}_2\text{O}) = m(\text{р-ра}) - m(\text{в-ва});$
$m(\text{H}_2\text{O}) = \text{}$
Объем воды рассчитаем по известной формуле $V = \frac{m}{\rho}$, где $\rho(\text{H}_2\text{O}) = 1 \text{ г}/\text{см}^3$.
Вывод. Для приготовления раствора мне необходимо взвесить _____ г соли и отмерить мерным цилиндром _____ см$^{3}$ (мл) воды.
При составлении отчета вставьте необходимые данные в графе «Этапы работы», сделайте поясняющие надписи на рисунках в графе «Выполнение опыта».
II. Приготовление раствора
Этапы работы
Выполнение опыта
Вывод (результат этапа работы)
1. Взвешивание вещества:
уравновесьте на весах маленький стаканчик или бюкс (левая чаша весов);
положите пинцетом на правую чашу весов необходимый набор гирь (_____ г);
осторожно насыпьте необходимое количество вещества;
перенесите навеску в колбу для приготовления раствора.
2. Измерение объема воды
Из стакана налейте _____ см$^{3}$ воды, снимая последнюю каплю о край цилиндра. Объем воды определяется по нижнему краю мениска (2).
3. Приготовление раствора
В колбу с приготовленной навеской медленно вливайте отмеренное количество воды при постоянном перемешивании (до полного растворения соли).
4. Подготовка раствора к хранению и последующему использованию:
перелейте приготовленный раствор в склянку для хранения (через воронку по стеклянной палочке);
приготовьте и наклейте этикетку.
На этикетке укажите:
химическую формулу вещества;
название вещества;
массовую долю вещества в растворе.
Сдайте приготовленный раствор учителю (лаборанту).
III. Разбавление раствора (расчет)
К 50 г приготовленного вами раствора добавили воду массой:
а) 30 г; б) 110 г; в) 70 г; г) 100 г.
Определите массовую долю соли в новом растворе.
Дано:
$m_1(\text{р-ра}) = 50 \text{....г}$
$w_1(\text{...}) = \text{....}$
$m(\text{...}) = \text{... г}$
$w_2(\text{...}) = \text{?}$
Решение
Ответ:
Вывод
2. Приготовление раствора с заданной молярной концентрацией вещества
Задание 2
Приготовьте раствор объемом _____ см$^{3}$, молярная концентрация соли _____ в котором равна
в) 250 см$^{3}$; 0,1 моль/дм$^{3}$; соль
I. Расчет необходимой массы твердого вещества
Дано:
$V(\text{р-ра ....}) = \text{...}$
$c(\text{....}) = \text{...}$
$m(\text{....}) = \text{?}$
Решение
Таким образом, для приготовления раствора объемом _____, молярная концентрация _____ (название вещества) в котором равна _____, мне необходимо взвесить
II. Приготовление раствора
Этапы работы
Выполнение опыта
Вывод
1. Взвешивание вещества
Для приготовления раствора взвешено _____ г
Решение. вариант 3 (с. 18)






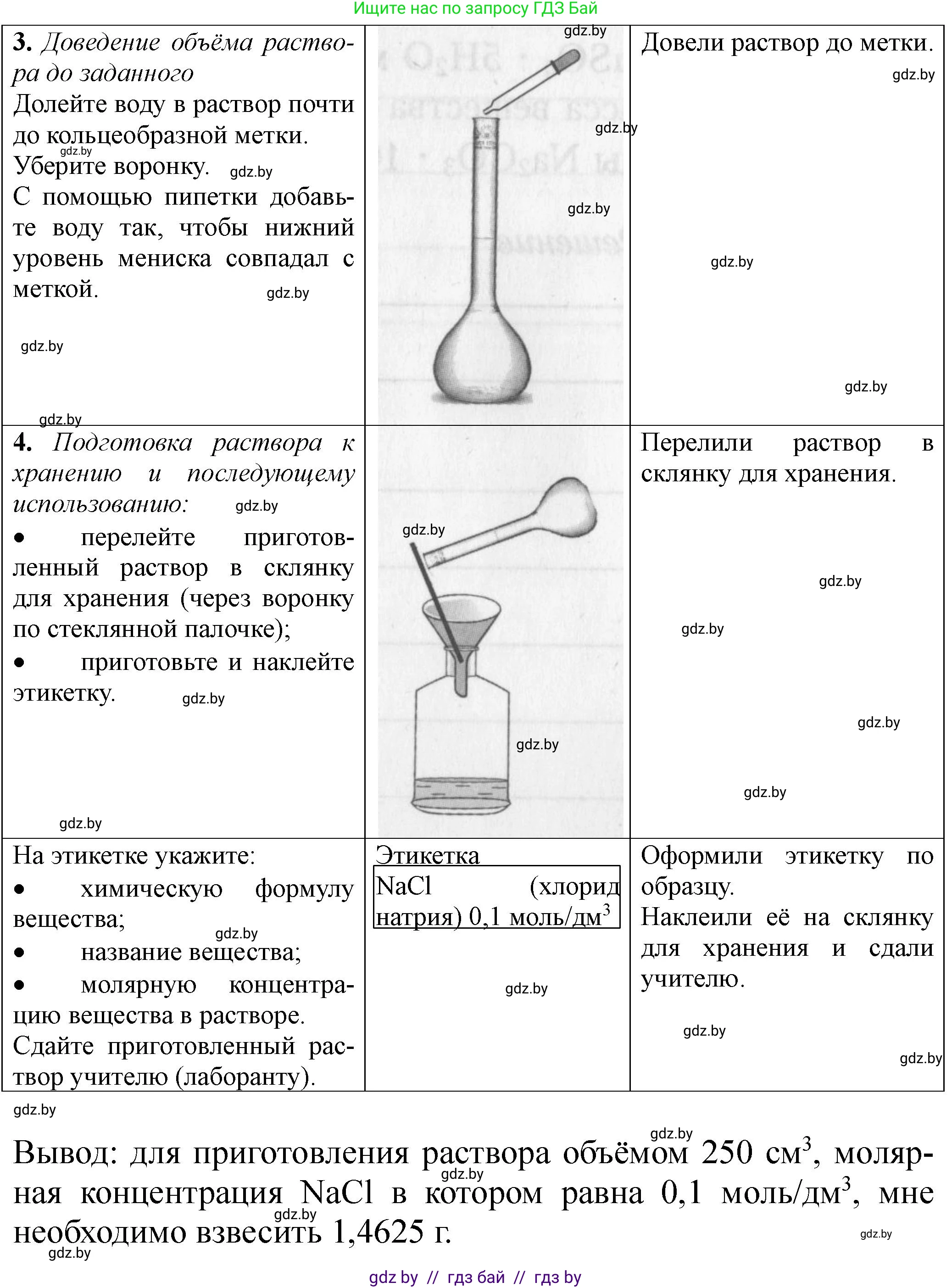

Решение 2. вариант 3 (с. 18)
Задание 1: в) 120 г; 5% KCl;
Дано:
Масса раствора $m_{раствора} = 120 \text{ г}$
Массовая доля хлорида калия $w_{KCl} = 5\% = 0.05$
Плотность воды $\rho_{H_2O} = 1 \text{ г/см}^3$
Перевод в СИ:
$m_{раствора} = 120 \text{ г} = 0.120 \text{ кг}$
$w_{KCl} = 0.05$
$\rho_{H_2O} = 1 \text{ г/см}^3 = 1000 \text{ кг/м}^3$
Найти:
Масса KCl $m_{KCl}$
Объем воды $V_{H_2O}$
Решение:
Массовая доля вещества в растворе определяется формулой:
$w_{вещества} = \frac{m_{вещества}}{m_{раствора}}$
Из этой формулы выразим массу вещества:
$m_{вещества} = w_{вещества} \cdot m_{раствора}$
Подставим значения для KCl:
$m_{KCl} = 0.05 \cdot 120 \text{ г} = 6 \text{ г}$
Масса воды в растворе находится как разность массы раствора и массы вещества:
$m_{H_2O} = m_{раствора} - m_{KCl}$
$m_{H_2O} = 120 \text{ г} - 6 \text{ г} = 114 \text{ г}$
Объем воды рассчитывается по формуле:
$V_{H_2O} = \frac{m_{H_2O}}{\rho_{H_2O}}$
Принимая плотность воды за $1 \text{ г/см}^3$:
$V_{H_2O} = \frac{114 \text{ г}}{1 \text{ г/см}^3} = 114 \text{ см}^3$
Ответ: Для приготовления раствора массой 120 г с массовой долей KCl 5% необходимо взвесить 6 г KCl и отмерить 114 см³ воды.
Задание 1: III. Разбавление раствора (расчет)
Дано:
Начальная масса раствора $m_{1(р-ра)} = 50 \text{ г}$
Начальная массовая доля соли $w_{1(соли)} = 5\% = 0.05$
Масса добавленной воды $m_{доб.H_2O}$ (варьируется в зависимости от варианта)
Перевод в СИ:
$m_{1(р-ра)} = 50 \text{ г} = 0.050 \text{ кг}$
$w_{1(соли)} = 0.05$
Для каждого варианта:
а) $m_{доб.H_2O} = 30 \text{ г} = 0.030 \text{ кг}$
б) $m_{доб.H_2O} = 110 \text{ г} = 0.110 \text{ кг}$
в) $m_{доб.H_2O} = 70 \text{ г} = 0.070 \text{ кг}$
г) $m_{доб.H_2O} = 100 \text{ г} = 0.100 \text{ кг}$
Найти:
Массовая доля соли в новом растворе $w_{2(соли)}$ для каждого варианта.
Решение:
Сначала найдем массу соли в исходном растворе:
$m_{соли} = w_{1(соли)} \cdot m_{1(р-ра)}$
$m_{соли} = 0.05 \cdot 50 \text{ г} = 2.5 \text{ г}$
При добавлении воды масса соли не меняется, меняется только масса раствора.
Новая масса раствора будет:
$m_{2(р-ра)} = m_{1(р-ра)} + m_{доб.H_2O}$
Новая массовая доля соли:
$w_{2(соли)} = \frac{m_{соли}}{m_{2(р-ра)}}$
Расчеты для каждого варианта:
а) Масса добавленной воды $30 \text{ г}$:
$m_{2(р-ра)} = 50 \text{ г} + 30 \text{ г} = 80 \text{ г}$
$w_{2(соли)} = \frac{2.5 \text{ г}}{80 \text{ г}} = 0.03125$
Массовая доля в процентах: $0.03125 \cdot 100\% = 3.125\%$
б) Масса добавленной воды $110 \text{ г}$:
$m_{2(р-ра)} = 50 \text{ г} + 110 \text{ г} = 160 \text{ г}$
$w_{2(соли)} = \frac{2.5 \text{ г}}{160 \text{ г}} = 0.015625$
Массовая доля в процентах: $0.015625 \cdot 100\% = 1.5625\%$
в) Масса добавленной воды $70 \text{ г}$:
$m_{2(р-ра)} = 50 \text{ г} + 70 \text{ г} = 120 \text{ г}$
$w_{2(соли)} = \frac{2.5 \text{ г}}{120 \text{ г}} \approx 0.020833$
Массовая доля в процентах: $0.020833 \cdot 100\% \approx 2.083\%$
г) Масса добавленной воды $100 \text{ г}$:
$m_{2(р-ра)} = 50 \text{ г} + 100 \text{ г} = 150 \text{ г}$
$w_{2(соли)} = \frac{2.5 \text{ г}}{150 \text{ г}} \approx 0.016667$
Массовая доля в процентах: $0.016667 \cdot 100\% \approx 1.667\%$
Ответ:
а) Массовая доля соли в новом растворе: $3.125\%$.
б) Массовая доля соли в новом растворе: $1.5625\%$.
в) Массовая доля соли в новом растворе: $2.083\%$.
г) Массовая доля соли в новом растворе: $1.667\%$.
Задание 3: в) соляной кислоты, масса вещества в котором 3,65 г;
Дано:
Объем раствора $V_{раствора} = 500 \text{ см}^3$
Масса соляной кислоты (HCl) $m_{HCl} = 3.65 \text{ г}$
Перевод в СИ:
$V_{раствора} = 500 \text{ см}^3 = 0.5 \text{ дм}^3 = 0.0005 \text{ м}^3$
$m_{HCl} = 3.65 \text{ г} = 0.00365 \text{ кг}$
Найти:
Молярная концентрация $c_{HCl}$
Решение:
Молярная концентрация определяется как количество вещества, деленное на объем раствора:
$c = \frac{n}{V_{раствора}}$
Количество вещества $n$ можно найти, разделив массу вещества на его молярную массу:
$n = \frac{m}{M}$
Сначала найдем молярную массу соляной кислоты (HCl):
Атомная масса H $\approx 1.008 \text{ г/моль}$
Атомная масса Cl $\approx 35.453 \text{ г/моль}$
$M_{HCl} = M_H + M_{Cl} = 1.008 \text{ г/моль} + 35.453 \text{ г/моль} = 36.461 \text{ г/моль}$
Теперь рассчитаем количество молей HCl:
$n_{HCl} = \frac{3.65 \text{ г}}{36.461 \text{ г/моль}} \approx 0.10010 \text{ моль}$
Далее рассчитаем молярную концентрацию. Удобнее использовать объем в дм³ для получения моль/дм³ (моль/л):
$V_{раствора} = 500 \text{ см}^3 = 0.5 \text{ дм}^3$
$c_{HCl} = \frac{0.10010 \text{ моль}}{0.5 \text{ дм}^3} \approx 0.2002 \text{ моль/дм}^3$
Округляя до трех значащих цифр:
$c_{HCl} \approx 0.200 \text{ моль/дм}^3$
Ответ: Молярная концентрация соляной кислоты в растворе равна $0.200 \text{ моль/дм}^3$.
Задание 2: в) 250 см³; 0,1 моль/дм³; соль
Дано:
Объем раствора $V_{раствора} = 250 \text{ см}^3$
Молярная концентрация $c = 0.1 \text{ моль/дм}^3$
Соль: Хлорид натрия (NaCl) - принято как наиболее распространенная соль в школьных задачах при отсутствии конкретного указания.
Перевод в СИ:
$V_{раствора} = 250 \text{ см}^3 = 0.250 \text{ дм}^3 = 0.000250 \text{ м}^3$
$c = 0.1 \text{ моль/дм}^3 = 100 \text{ моль/м}^3$
Найти:
Масса NaCl $m_{NaCl}$
Решение:
Молярная концентрация $c$ связана с количеством вещества $n$ и объемом раствора $V_{раствора}$ по формуле:
$c = \frac{n}{V_{раствора}}$
Отсюда, количество вещества $n$ равно:
$n = c \cdot V_{раствора}$
Масса вещества $m$ связана с количеством вещества $n$ и молярной массой $M$ по формуле:
$m = n \cdot M$
Сначала найдем молярную массу хлорида натрия (NaCl):
Атомная масса Na $\approx 22.99 \text{ г/моль}$
Атомная масса Cl $\approx 35.45 \text{ г/моль}$
$M_{NaCl} = M_{Na} + M_{Cl} = 22.99 \text{ г/моль} + 35.45 \text{ г/моль} = 58.44 \text{ г/моль}$
Теперь рассчитаем количество молей NaCl, необходимое для раствора:
$n_{NaCl} = c \cdot V_{раствора}$
$n_{NaCl} = 0.1 \text{ моль/дм}^3 \cdot 0.250 \text{ дм}^3 = 0.025 \text{ моль}$
Наконец, рассчитаем массу NaCl:
$m_{NaCl} = n_{NaCl} \cdot M_{NaCl}$
$m_{NaCl} = 0.025 \text{ моль} \cdot 58.44 \text{ г/моль} = 1.461 \text{ г}$
Округляя до трех значащих цифр (исходя из точности объема раствора):
$m_{NaCl} \approx 1.46 \text{ г}$
Ответ: Для приготовления раствора объемом 250 см³ с молярной концентрацией 0.1 моль/дм³ хлорида натрия (NaCl) необходимо взвесить $1.46 \text{ г}$ хлорида натрия.
Другие задания:
вариант 1
стр. 10вариант 1
стр. 14вариант 2
стр. 14вариант 3
стр. 14вариант 4
стр. 14вариант 1
стр. 18вариант 2
стр. 18вариант 3
стр. 18вариант 4
стр. 18лабораторный опыт 1
стр. 2лабораторный опыт 2
стр. 4лабораторный опыт 3
стр. 6лабораторный опыт 4
стр. 91
стр. 112
стр. 11к содержанию
список заданийПомогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения вариант 3 расположенного на странице 18 для 1-й части к тетради для практических работ 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению вариант 3 (с. 18), автора: Борушко (Ирина Ивановна), 1-й части учебного пособия издательства Сэр-Вит.














